Resenha do artigo:
Suzumura EA, Ascef BO, Maia FHA, Bortoluzzi AFR, Domingues SM, Farias NS, Gabriel FC, Jahn B, Siebert U, de Soarez PC. Methodological guidelines and publications of benefit-risk assessment for health technology assessment: a scoping review. BMJ Open. 2024 Jun 8;14(6):e086603. doi: 10.1136/bmjopen-2024-086603.
A avaliação de benefício-risco (ABR) é um componente essencial na tomada de decisões ao longo do ciclo de vida de uma tecnologia em saúde. Abordagens estruturadas para ABR têm sido utilizadas, em particular no contexto de decisões regulatórias e vigilância pós-comercialização. No contexto da Avaliação de Tecnologias em Saúde (ATS), até onde sabemos, os esforços para usar abordagens formais para ABR estão em uma fase preliminar em comparação ao cenário regulatório.
No Brasil, o conteúdo dos dossiês submetidos ao órgão nacional de ATS, a Comissão Nacional de Incorporação de Tecnologias (CONITEC), deve incluir uma descrição das evidências clínicas (eficácia, efetividade, acurácia diagnostica, segurança) sobre a tecnologia de interesse em comparação com as tecnologias disponíveis no Sistema Único de Saúde. No entanto, atualmente nenhuma recomendação sobre o escopo, os métodos e o relato do balanço entre benefícios e riscos é fornecida pela CONITEC.
Esta é a primeira revisão de escopo com o objetivo de mapear diretrizes metodológicas e publicações sobre métodos de ABR, especialmente no contexto da ATS.
As buscas foram conduzidas em três fontes principais até março de 2023: 1) bases de da dados eletrônicas; 2) literatura cinzenta (48 agências de ATS e organizações regulatórias) e 3) busca manual e contato com especialistas. Incluímos diretrizes metodológicas ou publicações apresentando métodos para conduzir ou relatar ABR sobre qualquer tipo de tecnologia de saúde em qualquer contexto do ciclo de vida da tecnologia. O processo de seleção e o mapeamento de dados foram conduzidos por revisores independentes. Uma síntese narrativa estruturada dos achados foi apresentada.
Mais de 13.000 referências foram identificadas nas três fontes de dados. Dos 83 documentos elegíveis, seis foram produzidos no contexto de ATS, 30 no regulatório e 35 envolveram orientação para ABR ao longo do ciclo de vida da tecnologia (Figura 1). Identificamos 129 abordagens metodológicas para ABR nos documentos. Os frameworks descritivos mais comumente referidos foram o Problem, Objectives, Alternatives, Consequences, Trade-offs, Uncertainty, Risk and Linked decisions (PrOACT-URL) e o Benefit–Risk Action Team (BRAT). A análise de decisão multicritério (ADMC) foi o framework quantitativo mais comumente citado. Além disso, foram identificados os índices métricos (metric indices), técnicas de estimação (estimation techniques) e técnicas de elicitação de utilidades (utility survey techniques) que podem ser utilizados para ABR (Figura 2).
Esta revisão representa um dos produtos de um projeto maior que visa propor inovações metodológicas, ferramentas instrumentais e processos de validação de métodos e instrumentos em ATS no Brasil. O projeto, desenvolvido pelo Programa de Pós-Graduação em Saúde Coletiva da FMUSP, é financiado pelo CNPq e conta com apoio da Rede Brasileira de Avaliação de Tecnologias em Saúde (REBRATS) e do IATS. O projeto promoveu em Dezembro de 2023 uma capacitação sobre o uso de técnicas de modelagem analítica de decisão para ABR e discutiu seu potencial de aplicação no contexto da ATS no Brasil (https://www.iats.com.br/2023/12/fmusp-e-umit-tirol-promovem-workshop-sobre-avaliacao-de-beneficio-risco-em-ats/). Os achados desta revisão de escopo informarão o desenvolvimento de uma diretriz metodológica sobre ABR para a CONITEC.
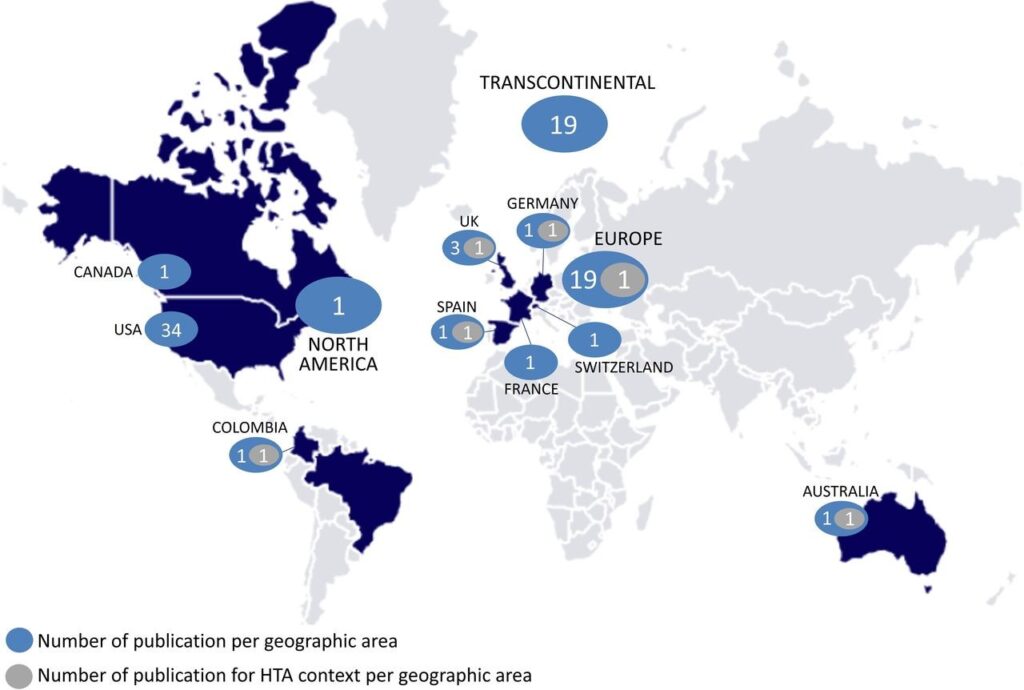
Figura 1. Número de documentos publicados por área geográfica. Transcontinental significa ≥2 países de diferentes continentes. Continente (Europa, América do Norte) significa ≥2 países dentro do mesmo continente. HTA (do inglês Health Technology Assessment): Avaliação de Tecnologia em Saúde.
| Elaborada por |
|---|
| Erica Aranha Suzumura Bruna de Oliveira Ascef Fernando Henrique de Albuquerque Maia Aline Frossard Ribeiro Bortoluzzi Sidney Marcel Domingues Natalia Santos Farias Franciele Cordeiro Gabriel Beate Jahn Uwe Siebert Patricia Coelho de Soarez |
| Data da Resenha |
|---|
| 24/06/2024 |
| Eixo Temático |
|---|
| Serviços de Saúde e Políticas Públicas |
| Eixo Metodológico |
|---|
| Plataforma Metodológica de Apoio à Avaliação e Monitoramento de Tecnologias em Saúde |

Figura 2. Abordagens metodológicas para BRA identificadas nos documentos incluídos.
AE-NNT, adverse event-adjusted number needed to treat; AHP, analytic hierarchy process; ASF, Ashby and Smith framework; Beckmann, Beckmann model (evidence-based model); BLRA, benefit-less-risk analysis; BRAT, Benefit–Risk Action Team; BRR, benefit–risk ratio; CA, conjoint analysis; CDS, cross-design synthesis; CUI, Clinical Utility Index; CMR-CASS, CMR Health Canada, Australia’s Therapeutic Goods Administration, SwissMedic and Singapore Health Science Authority; CPM, confidence profile method; COBRA, consortium on benefit–risk assessment; CV, contingent valuation; DAG, directed acyclic graphs; DALY, disability-adjusted life years; DAM, decision analytic model (no specific designation was given to the model); DCE, discrete choice experiment; DI, Desirability Index; FDA BRF, FDA benefit–risk framework; GBR, global benefit–risk; HALE, health-adjusted life years; INHB, incremental net health benefit; ITC, indirect treatment comparison; KM, Kaplan-Meier; MAR, maximum acceptable risk; MCDA, multicriteria decision analysis; MCE, minimum clinical efficacy; MDP, Markov decision process; MTC, mixed treatment comparison; NCB, net clinical benefit; NEAR, net efficacy adjusted for risk; NNH, number needed to harm; NNT, number needed to treat; PBRER, periodic benefit–risk evaluation report; Principle of 3’s, principle of threes; PrOACT-URL, Problem, Objectives, Alternatives, Consequences, Trade-offs, Uncertainty, Risk and Linked decisions; PROTECT, Pharmacoepidemiological Research on Outcomes of Therapeutics; PSM, probabilistic simulation method; QALY, quality-adjusted life years; Q-TWiST, quality-adjusted time without symptoms and toxicity; QFRBA, quantitative framework for risk and benefit assessment; RBAT, risk–benefit acceptability threshold; RBC, risk–benefit contour; RBP, risk–benefit plane; RV-MCE, relative value-adjusted minimum clinical efficacy; RV-NNH, relative value-adjusted number needed to (treat to) harm; RV-NNT, relative value-adjusted number needed to treat; SABRE, Southeast Asia benefit–risk evaluation; SBRAM, Sarac’s benefit–risk assessment; SG, standard gamble; SMAA, Stochastic multicriteria acceptability analysis; SPM, stated preference method; SW, swing weighting; TTO, time trade-off; TURBO, transparent uniform risk–benefit overview; UMBRA, unified methodologies for benefit–risk assessment; UT-NNT, utility-adjusted and time-adjusted number needed to treat.
*General (geral): nenhuma designação específica foi dada ao framework descritivo.
#Other (outro): abordagens citadas em <5 dos documentos incluídos.
Numbers are presented (as number of documents citing the approach; proportion of the total 83 documents).
Números estão apresentados como: (número de documentos citando a abordagem; proporção do total de 83 documentos).
